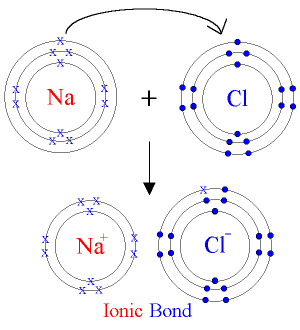
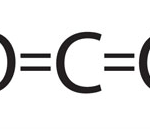Posteriorment a Thomson, Rutherford va continuar investigant l’àtom i arribà a unes conclusions tant importants que després dels seus treballs el model de Thomson ja no servia.
1. Busca a quina època va viure Rutherford.
2. Busca quin important laboratori va dirigir.
Rutherford va aconseguir explicar els resultats del famós experiment de la làmina d’or.
En aquest experiment Rutherfod prengué una fina l’amina d’or i la bombardejà amb partícules alfa (partícules molyt petites carregades positivament). A l’altra banda de la làmina d’or hi havien uns sensors capaços de detectar les partícules alfa que havien travessat la làmina.
3. Digues quantes partícules alfa s’esperaria que atravessessin la làmina si els àtoms fossin tal i com el model de Thomson preveia.
Com et pots imaginar els resultats obtinguts no van coincidir amb els esperats i per això el model de Thomson començava a esquerdar-se.
4. Explica perquè si els resultats no quadraven amb el model proposat per Thomson el que s’havia de canviar era el model i no els resultats ?
En bombardejar la làmina, Rutherford s’adonà que el 99% de les partícules alfa travessaven la làmina sense desviar-se. Un 0,9% travessaven sense desviar-se i només un 0,1 % rebotaven i per tant no travessaven.
5. Explica perquè aquests resultats no es podien explicar amb el model de Thomson.
En conseqüència Rutherford va proposar el següent model:
-L’Àtom no podia ser massís ja que si ho fos la majoria de particules alfa no passarien i en canvi passaven quasi totes.
-En esssència l’àtom havia de ser buit, ja que passaven el 99% de les partícules però no podia ser negatiu ja que la matèria era neutra. Per tant Rutherford va suposar que hi havia unes partícules molt petites i carregades positivament que ocupaven molt poc lloc. A aquestes partícules els posà el nom de protons.
Com que l’àtom era buit ara ja s’explicava que la majoria de partícules alfa passessin, i també s’explicava que algunes poques rebotessin ja que eren les que xocaven contra els protons. Les que hi passaven a prop eren desviades perquè les càrregues del mateix signe es rebutgen.
Semblava que tot quadrava a la perfecció però hi havia dos problemes més que feien que l’àtom de Rutherford no pogués existir.
6. Intenta descobrir, abans de seguir llegint, quins eren aquests dos problemes.








 j
j