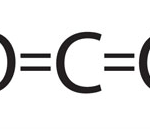Enllaç covalent – OBSERVA I ANOTA
En l’enllaç iònic, els àtoms s’uneixen mitjançant la pèrdua d’electrons de l’últim nivell i el guany d’aquests per part de l’altre àtom. D’aquesta manera, els elements dels grups I , II i III s’uneixen amb facilitat amb els elements dels grups XV, XVI i XVI.
No obstant, existeix una altre mètode per unir-se: la compartició dels electrons. Fixa’t en la imatge següent:

La molècula de metà (CH4) s’uneix mitjançant l’enllaç covalent. Aquest consisteix en compartir els electrons de l’última capa de valència entre els àtoms que formen la molècula. En el cas del carboni (que té 4 electrons a l’última capa), pretén aconseguir-ne 4 més per assolir la estabilitat màxima (completar el nombre màxim d’electrons a l’última capa, és a dir, 8). Per fer-ho, els “agafa” de 4 hidrògens. De la mateixa manera, l’Hidrogen pretén assolir una estabilitat major omplint el seu primer i únic nivell (al qual hi caben dos electrons i prou). Cada hidrogen doncs, “agafa” un dels electrons del Carboni per assolir l’estabilitat màxima.
D’aquesta manera s’uneixen la majoria de biomolècules orgàniques, com l’aigua (H2O) i la glucosa (C6H12O6) , així com d’altres molt més complexes.
Mira’t el vídeo següent i distingeix els dos enllaços que hem vist fins ara. Sabries esquematitzar la unió dels àtoms de C i O per formar el diòxid de carboni? Fes-ho a la llibreta.
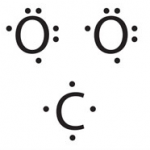
Representació de Lewis – INVESTIGA
Existeix una manera molt interessant per entender i representar els enllaços covalents. S’anomena representación de Lewis i tot seguit t’adjuntem tres imatges d’aquesta representació. Estan ordenades cronològicament. És a dir la primera és abans de que els àtoms s’uneixin i la darrera és un cop están units.
Series capaç de descobrir com funciona aquesta representació ? i sobretot copsar la seva utilitat ?
Algunes representacions – PRACTICA
Ara que ja saps com es representen els enllaços covalents, almenys sobre el paper, seria qüestió de fer una mica de pràctica. Algunes són molt fàcils però d’altres es compliquen molt. A veure com se’t dóna…
Et proposem que representis les següents molècules que s’uneixen per mitjà d’un enllaç covalent.
N2; NH3; C2H6; C4H10; CH4O; CCl4; C2H6O
Enllaç covalent – VIDEOS
A continuació tens dos vídeos sobre enllaços covalents. Fes-hi un cop d’ull.
oxygen_double_bond (Enllaç covalent de la molècula d’oxigen).
covalent_bond_water (Enllaç covalent de la molècula d’aigua).
Repassem els enllaços – OBSERVA I ANOTA
Fins ara hem començat a veure quines característiques presenta l’enllaç iònic i el procediment pel qual es duu a terme. Recordes quins altres dos tipus d’enllaços hi ha? Com s’anomenen?

Mira’t la següent presentació i consolida el que saps sobre l’enllaç iònic. a més a més, comença a buscar les diferències entre els dos altres tipus d’enllaç.
Després el professor farà una explicació amb apunts que hauràs de tenir ben organitzats al diari de classe. Som-hi!
Enllaç metàl·lic – INVESTIGA
Llegeix el següent text que defineix l’enllaç metàl·lic. Destaca’n les paraules importants i intenta fer-te una idea del què és aquest tipus d’enllaç:
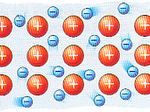
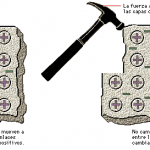
L’enllaç metàl·lic és característic dels elements metàl·lics, és un enllaç fort, primari, que es forma entre elements de la mateixa espècie. Els àtoms, a l’estar tan propers l’un de l’altre, interaccionen els nuclis juntament amb els seus núvols electrònics empaquetant-se en les tres dimensions, pel que queden envoltats de tals núvols. Aquests electrons lliures són els responsables que els metalls presentin una elevada conductivitat elèctrica i tèrmica, ja que aquests es poden moure amb facilitat si es posen en contacte amb una font elèctrica. Presenten lluentor i són mal·leables.
Els elements amb un enllaç metàl·lic estan compartint un gran nombre d’electrons de valència, formant un mar d’electrons envoltant un enreixat gegant de cations.
Tot seguit tens unes imatges que et poden ajudar: