Pensa possibles maneres d’ordenar-los i anota-les als apunts. Tot seguit les posarem en comú i triarem les que ens semblin millor.
La taula periòdica – OBSERVA
Ja has vist que molts dels mètodes que heu proposat per a la classificació dels elements químics no són massa vàlids. El 1869, el senyor de la fotografia va proposar un sistema de classificació que es coneix com a Taula Periòdica dels Elements i que corregida és la que avui encara s’utilitza. Et demanem ara que en consultis una i esbrinis per quina característica están ordenats els àtoms. Si ets observador en trobaràs una, si ho ets encara més en trobaràs dues, i si ho ets molt veuràs que només una de les dues és vàlida.

Tornem a la taula periòdica
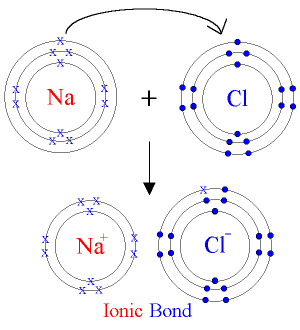
Els ions
Fins ara hem vist l’estructura interna d’un àtom i sabràs que el balanç entre les càrregues elèctriques entre els electrons (negativa), protons (positiva) i neutrons (neutra) és zero. Per tant, les càrregues elèctriques d’un àtom estan compensades.
Pensa però, si aquesta estructura pot variar en funció de la pèrdua o de la incorporació d’alguna d’aquestes partícules. Fixa’t en la imatge següent i busca el nom dels àtoms o les molècules que sofreixen aquestes modificacions:
The elements song by Theodore Gray
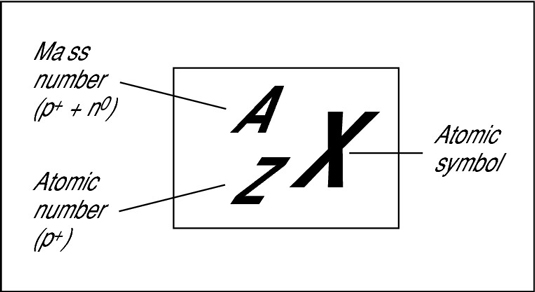
Nombre atòmic i nombre màssic-OBSERVA I ANOTA
Observa atentament aquestes imatges. Què en dedueixes? Pensa-hi una estoneta i en parlem a classe.
Per practicar pots fer els següents exercicis online.
Ara fes els exercicis següents a la teva llibreta.
Les unitats de massa atòmica – PENSA
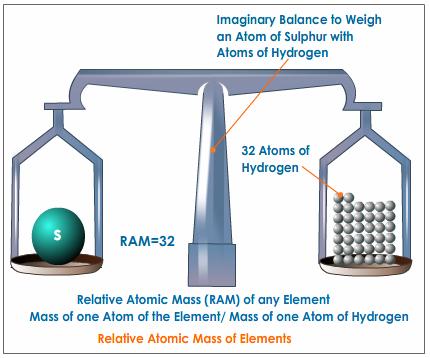
La massa atòmica – INVESTIGA
Ja has vist que els àtoms estan formats per tres partícules bàsiques. Hem parlat de la càrrega elèctrica d’aquestes partícules però ara és el moment de dir alguna cosa sobre la seva massa.
Pesa un àtom ? Què en penses ?
Si la resposta és afirmativa i l’àtom només està format per electrons, neutrons i protons quina conclusió en treus ? és a dir què és el que fa que l’àtom pesi ?
T’avancem que una de les tres partícules no influeix en la massa de l’àtom. Amb un minut i abans de continuar llegint, busca quina és aquesta partícula i busca si les altres dues pesen i quant pesen. Anota-ho al diari.
Clica aquesta taula periòdica i busca a veure si ens dóna informació sobre el número màssic. El trobes ? Mira-ho bé. Hi és o no ?
Ara clica de nou la mateixa taula periòdica d’abans i busca si hi ha la massa atòmica ? Hi és ? Si hi és busca els àtoms d’hidrogen, de carboni, d’oxigen i de ferro anota’n la seva massa atòmica al diari de classe.
Què et sorprèn d’aquestes masses ?
Intenta trobar-hi una explicació. Si vols una pista clica aquí. Hi trobaràs una taula anomenada “Taula dels isòtops”.
A veure si te’n surts !
Llegim-ho a poc a poc – TEORIA
Càlcul de la massa molecular – PRACTICA
Configuració electrònica – INVESTIGA
Si els àtoms només estiguessin ordenats segons el numero atòmic, perquè l’hidrogen i l’heli estan tant lluny l’un de l’altre ? o en canvi el sodi i el magnesi estan tant a prop ?
La solució es troba en les electrons. Observa bé aquestes imatges i treu-ne coclusions. Seria bo que en una pantalla a part tinguessis oberta una taula periòdica.
Ah sí ! Sàpigues que aquestes imatges fan referència a la configuració electrònica que veureu a fons a 4t d’ESO.
Si no n’has acabat de treure l’aigua clara et deixem aquí aquest document que de ben segur t’ajudaràs. Som-hi !