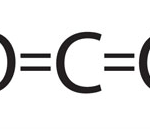Les dimensions de l’àtom – LLEGEIX
Però, a desgrat d’aquesta enorme quantitat d’elements que hi ha a l’ interior d’una partícula de matèria, aquests elements són tan infinitament minúsculs i estan tan separats que entre les partícules elementals hi ha un buit inmens. Avui que qualsevol cosa diuen que al·lucina, proposo al lector barceloní aquests joc d’ imaginació: que clavi una agulla en un coixí del seu sofà. Si el cap d’ aquesta agulla representés el protó d’un nucli d’oxígen, l’electró que gira al seu voltant seguiria una circumferència que passaria per Portugal,França,Itàlia i Algèria.
Entre Barcelona i París ,per dir-ho així,res.Les partícules que constitueixen una clau de ferro,el tronc d’ un arbre, el d’ un gos es mouen en un enorme desert buit.J.M.Espinàs,Avui(14 set.1991)”
Reforç-Aparell excretor
Llegeix atentament el següent document i fes els exercicis que s’hi adjunten en el teu diari de classe.
Els models atòmics – AUTOQÜESTIONARI
Respon el següent autoqüestionari sobre els models atòmics per repassar.
La necessitat d’ordenar – PENSA
Pensa possibles maneres d’ordenar-los i anota-les als apunts. Tot seguit les posarem en comú i triarem les que ens semblin millor.
La taula periòdica – OBSERVA
Ja has vist que molts dels mètodes que heu proposat per a la classificació dels elements químics no són massa vàlids. El 1869, el senyor de la fotografia va proposar un sistema de classificació que es coneix com a Taula Periòdica dels Elements i que corregida és la que avui encara s’utilitza. Et demanem ara que en consultis una i esbrinis per quina característica están ordenats els àtoms. Si ets observador en trobaràs una, si ho ets encara més en trobaràs dues, i si ho ets molt veuràs que només una de les dues és vàlida.

Tornem a la taula periòdica
Aturem-nos-hi un moment – TEORIA
Els ions
Fins ara hem vist l’estructura interna d’un àtom i sabràs que el balanç entre les càrregues elèctriques entre els electrons (negativa), protons (positiva) i neutrons (neutra) és zero. Per tant, les càrregues elèctriques d’un àtom estan compensades.
Pensa però, si aquesta estructura pot variar en funció de la pèrdua o de la incorporació d’alguna d’aquestes partícules. Fixa’t en la imatge següent i busca el nom dels àtoms o les molècules que sofreixen aquestes modificacions:
The elements song by Theodore Gray
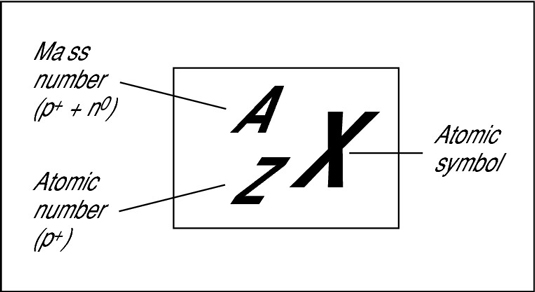
Nombre atòmic i nombre màssic-OBSERVA I ANOTA
Observa atentament aquestes imatges. Què en dedueixes? Pensa-hi una estoneta i en parlem a classe.
Per practicar pots fer els següents exercicis online.
Ara fes els exercicis següents a la teva llibreta.
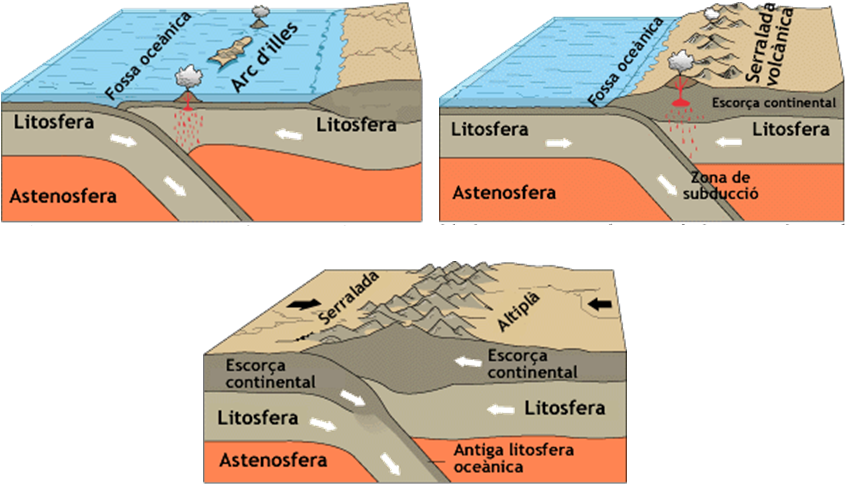
Els corrents de convecció – OBSERVA I ANOTA
Què passa quan els límits de les plaques es toquen?
I si les plaques s’allunyen?
Aquests límits s’anomenen divergents. En aquests límits, les plaques es separen i, just a la zona on es separen, puja material de l’astenosfera que, en refredar-se, forma noves roques que s’afegeixen als marges de les plaques.
 Quines són les conseqüències? Volcans i terratrèmols submarins, eixamplament dels oceans i formació d’una serralada a la zona per on surt el material de l’astenosfera que s’anomena dorsal oceànica.
Quines són les conseqüències? Volcans i terratrèmols submarins, eixamplament dels oceans i formació d’una serralada a la zona per on surt el material de l’astenosfera que s’anomena dorsal oceànica.
La falla de San Andrés i els límits transformants.
Els límits transformants tenen lloc a zones on dues plaques ni s’ajunten ni se separen sinó que es mouen lateralment, lliscant entre elles. Aquests límits no estan associats a l’aparició de volcans, però sí a terratrèmols.
L’exemple més conegut és el de la falla de San Andreas. Fes una recerca per internet i busca una mica d’informació (on es troba? Ha ocasionat terratrèmols recentment? Quines són les plaques que es mouen lateralment per a provocar aquesta falla?…).
En resum…
Prova-ho tu mateix!
A la recerca de les glàndules endocrines – POU
Fes una recerca per la xarxa i troba una imatge de cada una de les glàndules endocrines del cos. Et suggerim que facis una taula de qautre columnes on a la primera posis el nom de la glàndula, a la segona la localització, a la tercera el nom d’alguna de les hormones que fabrica i finalment a la quarta, la imatge de la glàndula.
Una vegada enllestit ho penges al pou anomenat: Glàndules endocrines”.
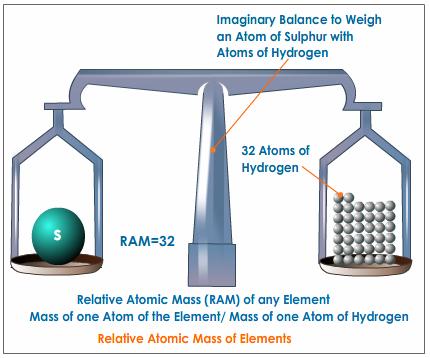
Les unitats de massa atòmica – PENSA
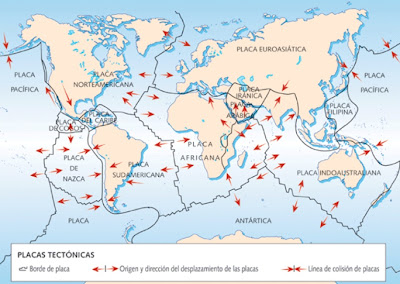
Mapamundi – OBSERVA
La massa atòmica – INVESTIGA
Ja has vist que els àtoms estan formats per tres partícules bàsiques. Hem parlat de la càrrega elèctrica d’aquestes partícules però ara és el moment de dir alguna cosa sobre la seva massa.
Pesa un àtom ? Què en penses ?
Si la resposta és afirmativa i l’àtom només està format per electrons, neutrons i protons quina conclusió en treus ? és a dir què és el que fa que l’àtom pesi ?
T’avancem que una de les tres partícules no influeix en la massa de l’àtom. Amb un minut i abans de continuar llegint, busca quina és aquesta partícula i busca si les altres dues pesen i quant pesen. Anota-ho al diari.
Clica aquesta taula periòdica i busca a veure si ens dóna informació sobre el número màssic. El trobes ? Mira-ho bé. Hi és o no ?
Ara clica de nou la mateixa taula periòdica d’abans i busca si hi ha la massa atòmica ? Hi és ? Si hi és busca els àtoms d’hidrogen, de carboni, d’oxigen i de ferro anota’n la seva massa atòmica al diari de classe.
Què et sorprèn d’aquestes masses ?
Intenta trobar-hi una explicació. Si vols una pista clica aquí. Hi trobaràs una taula anomenada “Taula dels isòtops”.
A veure si te’n surts !
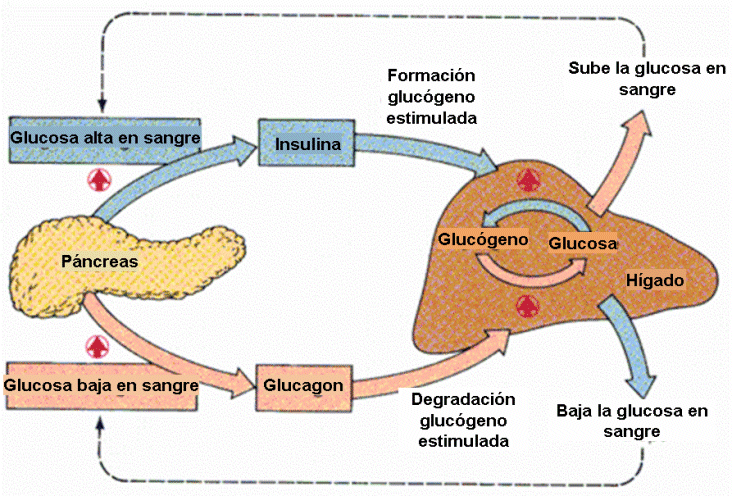
El sistema insulina-glucagó
Els punts calents de la Terra – INVESTIGA
Observa la següent animació i intenta arribar a conclusions.
Llegim-ho a poc a poc – TEORIA
L’aparell endocrí és jeràrquic – INVESTIGA
Atenció que aquesta activitat és de nivell !
A continuació tens una imatge (la pots clicar per fer-la més gran) que il·lustra el funcionament jeràrquic de l’aparell endocrí.
OBSERVA AMB ATENCIÓ EL DIBUIX I RESPON LES PREGUNTES EN EL TEU DIARI

1. On està situat l’hipotàlem ? quina creus que és la funció de l’hipotàlem ? què t’ho fa pensar ?
2.La hipòfisi està dividia en dues parts anomenades adenohipòfisi i neurohipòfisi. Tant l’una com l’altra segreguen hormones però quina diferència hi ha entre les hormones que fabrica una i altra part ? (Pista: la diferència no està tant en les hormones com en el seu recorregut).
3. Pel que fa a les hormones fabricades per l’adenohipòfisi, l’ACTH, la TSH, la FSH tenen una diferència important amb la GH i la LTH. Pensa quina pot ser.
Càlcul de la massa molecular – PRACTICA
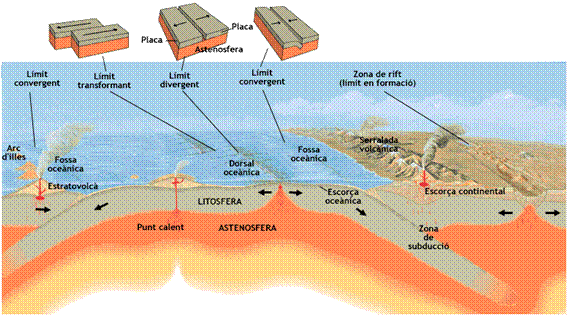
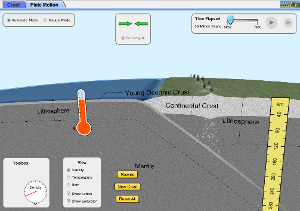
Tectònica de plaques – TEORIA
L’aparell endocrí – TEORIA
La teoria de la tectònica de plaques – INVESTIGA
A continuació tens una informació excel·lent sobre aquesta teoría. Tu mateix pots anar-la estudiant i demanar ajuda al professor sempre que ho necessitis. Clica AQUÍ.
Les capes de la Terra en percentatge – POU
Bona feina !
Reforç-Aparell digestiu (2)
LLegeix amb atenció el següent document i fes els exercicis que hi vagis trobant al teu diari de classe.
Configuració electrònica – INVESTIGA
Si els àtoms només estiguessin ordenats segons el numero atòmic, perquè l’hidrogen i l’heli estan tant lluny l’un de l’altre ? o en canvi el sodi i el magnesi estan tant a prop ?
La solució es troba en les electrons. Observa bé aquestes imatges i treu-ne coclusions. Seria bo que en una pantalla a part tinguessis oberta una taula periòdica.
Ah sí ! Sàpigues que aquestes imatges fan referència a la configuració electrònica que veureu a fons a 4t d’ESO.
Si no n’has acabat de treure l’aigua clara et deixem aquí aquest document que de ben segur t’ajudaràs. Som-hi !
Estabilitat i reactivitat – INVESTIGA
Model de geosfera – PRÀCTICA VOLUNTÀRIA
Repassem-ho una mica – TEORIA
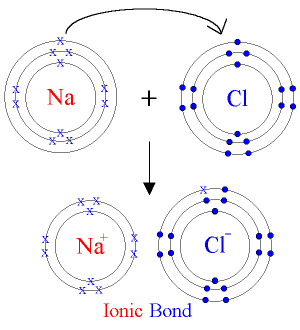
L’enllaç iònic – INVESTIGA
Enllaç covalent – OBSERVA I ANOTA
En l’enllaç iònic, els àtoms s’uneixen mitjançant la pèrdua d’electrons de l’últim nivell i el guany d’aquests per part de l’altre àtom. D’aquesta manera, els elements dels grups I , II i III s’uneixen amb facilitat amb els elements dels grups XV, XVI i XVI.
No obstant, existeix una altre mètode per unir-se: la compartició dels electrons. Fixa’t en la imatge següent:

La molècula de metà (CH4) s’uneix mitjançant l’enllaç covalent. Aquest consisteix en compartir els electrons de l’última capa de valència entre els àtoms que formen la molècula. En el cas del carboni (que té 4 electrons a l’última capa), pretén aconseguir-ne 4 més per assolir la estabilitat màxima (completar el nombre màxim d’electrons a l’última capa, és a dir, 8). Per fer-ho, els “agafa” de 4 hidrògens. De la mateixa manera, l’Hidrogen pretén assolir una estabilitat major omplint el seu primer i únic nivell (al qual hi caben dos electrons i prou). Cada hidrogen doncs, “agafa” un dels electrons del Carboni per assolir l’estabilitat màxima.
D’aquesta manera s’uneixen la majoria de biomolècules orgàniques, com l’aigua (H2O) i la glucosa (C6H12O6) , així com d’altres molt més complexes.
Mira’t el vídeo següent i distingeix els dos enllaços que hem vist fins ara. Sabries esquematitzar la unió dels àtoms de C i O per formar el diòxid de carboni? Fes-ho a la llibreta.
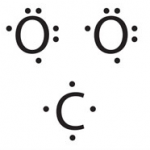
Representació de Lewis – INVESTIGA
Existeix una manera molt interessant per entender i representar els enllaços covalents. S’anomena representación de Lewis i tot seguit t’adjuntem tres imatges d’aquesta representació. Estan ordenades cronològicament. És a dir la primera és abans de que els àtoms s’uneixin i la darrera és un cop están units.
Series capaç de descobrir com funciona aquesta representació ? i sobretot copsar la seva utilitat ?
Alfred Wegener – INVESTIGA
Algunes representacions – PRACTICA
Ara que ja saps com es representen els enllaços covalents, almenys sobre el paper, seria qüestió de fer una mica de pràctica. Algunes són molt fàcils però d’altres es compliquen molt. A veure com se’t dóna…
Et proposem que representis les següents molècules que s’uneixen per mitjà d’un enllaç covalent.
N2; NH3; C2H6; C4H10; CH4O; CCl4; C2H6O
Enllaç covalent – VIDEOS
A continuació tens dos vídeos sobre enllaços covalents. Fes-hi un cop d’ull.
oxygen_double_bond (Enllaç covalent de la molècula d’oxigen).
covalent_bond_water (Enllaç covalent de la molècula d’aigua).
Repassem els enllaços – OBSERVA I ANOTA
Fins ara hem començat a veure quines característiques presenta l’enllaç iònic i el procediment pel qual es duu a terme. Recordes quins altres dos tipus d’enllaços hi ha? Com s’anomenen?

Mira’t la següent presentació i consolida el que saps sobre l’enllaç iònic. a més a més, comença a buscar les diferències entre els dos altres tipus d’enllaç.
Després el professor farà una explicació amb apunts que hauràs de tenir ben organitzats al diari de classe. Som-hi!
Enllaç metàl·lic – INVESTIGA
Llegeix el següent text que defineix l’enllaç metàl·lic. Destaca’n les paraules importants i intenta fer-te una idea del què és aquest tipus d’enllaç:
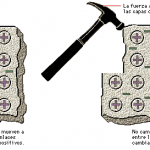
L’enllaç metàl·lic és característic dels elements metàl·lics, és un enllaç fort, primari, que es forma entre elements de la mateixa espècie. Els àtoms, a l’estar tan propers l’un de l’altre, interaccionen els nuclis juntament amb els seus núvols electrònics empaquetant-se en les tres dimensions, pel que queden envoltats de tals núvols. Aquests electrons lliures són els responsables que els metalls presentin una elevada conductivitat elèctrica i tèrmica, ja que aquests es poden moure amb facilitat si es posen en contacte amb una font elèctrica. Presenten lluentor i són mal·leables.
Els elements amb un enllaç metàl·lic estan compartint un gran nombre d’electrons de valència, formant un mar d’electrons envoltant un enreixat gegant de cations.
Tot seguit tens unes imatges que et poden ajudar:
Vacunem o no vacunem ?
Darrerament hi ha la “moda” de no vacunar. Això porta molts problemes. Aquesta entrevista ens pot aclarir els dubtes !
Reforç-Els aliments i l’alimentació
LLegeix amb atenció el següent document i fes els exercicis que hi vagis trobant al teu diari de classe.
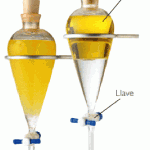
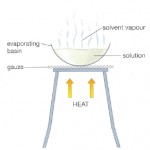
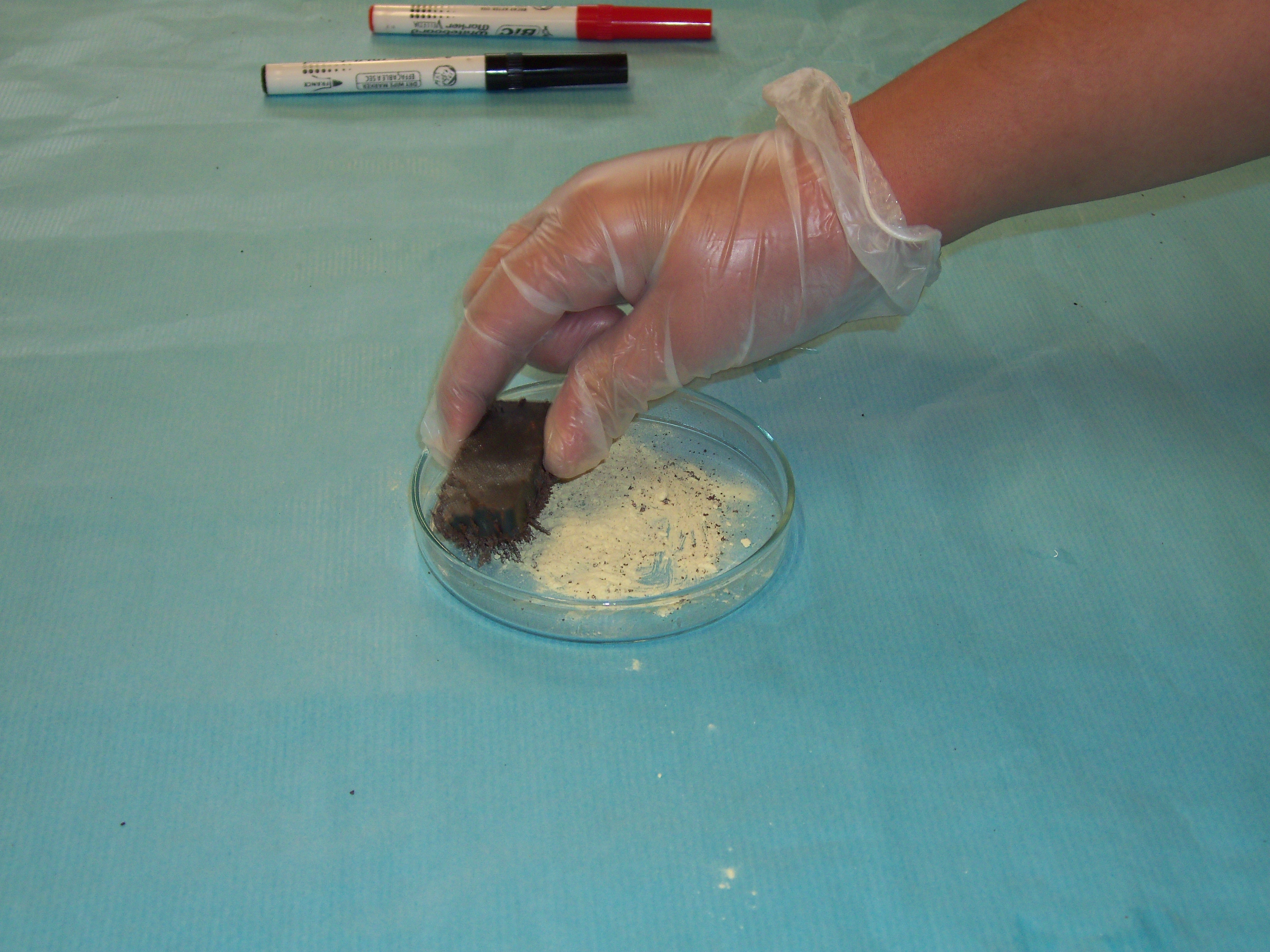
Mètodes de separació – INVESTIGA
Imagina que tens sobre la taula una barreja de sorra, llimadures de ferro, aigua, sal, oli, alcohol i iode i que el teu objectiu és separar-les en els components inicials.
Abans de continuar llegint pensa com ho faries.
Ep ! Hem dit que no llegiries.
Segurament hagis trobat alguns mètodes possibles. A continuació te’n posem les fotografies.A veure si els identifiques.
Finalment proposa un nom per a cada mètode.
Per deixar-ho clar – TEORIA
Mètodes de separació – REPASSA
Clica aquest enllaç per practicar una mica més sobre els mètodes de separació.
Substàncies pures, mescles i dissolucions – INVESTIGA
Els mètodes que has estudiat abans i que s’utilitzen per a separar substàncies són mètodes físics. Això vol dir que no s’altera la composició de les molècules, ja que no hi ha hagut cap reacció química.
Quan una determinada substància no es pot separar en cap altra de més simple per mètodes físcs diem que és una: (quin nom li posaries ?).
En cas contrari, si una substància, es pot separar en d’altres més simples per mètodes físics diem que es tractarà d’una: (i ara ?).
Finalment d’aquestes darreres n’hi ha de dos tipus. Unes anomenades heterògènies i unes altres d’homogènies.
Finalment et donem algunes substàncies perquè identifiquis de quin tipus dels tres possibles són:
Substància A: Aigua de l’aixeta.
Substància B: Vi.
Substància C: Oli d’oliva verge.
Substància D: Suc de taronja.
Substància E: Tinta de boligraf.
Substància F: Salsa bolognesa.
Reforç- Aparell circulatori
Llegeix atentament el següent document i fes els exercicis que s’hi adjunten en el teu diari de classe.